فیزیولوژی خون (3)
فیزیولوژی خون
شریان ها
وریدها
مویرگ ها
سیستم لنفاوی
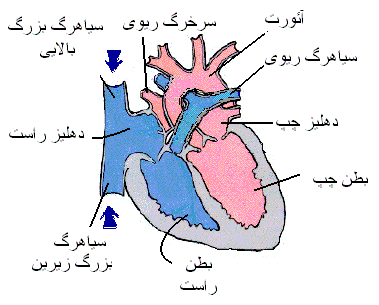
عروق خونی شبکه لوله مانندی را در سراسر بدن تشکیل میدهند که گردش خون از قلب به کلیه سلول ها ی زنده بدن و سپس بازگشت دوباره آن به قلب را میسر می کند. خون ترک کننده قلب از طریق عروقی که به طور پیش رونده قطر کوچک تری پیدا کرده ، به ترتیب شریان ها، شریانچه ها، مویرگ ها نامیده می شوند، عبو می کند.مویرگ ها که عروق ریزی هستد، جریان خون شریانی را به جریان خون وریدی ارتباط می دهند. خون برگشتی از مویرگ ها به قلب از طریق عروقی که به طور پیشرونده قطر بزرگتری یافته، و وریدچه ها ، ورید ها خوانده می شود، عبور می کند.
سیستم شریانی-وریدی در تصویر زیر:

دیواره های ورید و شریان در شکل زیر:

شریان ها با توجه به قطرشان در مقایسه با وریدهای هم اندازه خود، عضله بیشتری دارند. در نتیجه ، شریان ها در مقطع عرضی بیشتر مدور به نظر می رسند و جزئی جدار روی هم افتاده دارند. افزون بر این ، اغلب ورید ها دارای دریچه اند که این ویژگی در شریان ها دیده نمی شود.
شریان ها:
شریان های بزرگ به هنگام افزایش فشار در اثر انقباض قلب پهن شده، زمانی که فشار طی شلی بطن افت می کند، همانند نوار کشیده شده، به وضع اولیه خود بر می گردند. این برگشت پذیری الاستیک برای ایجاد جریان خون پیوسته و ملایم تر و کم ضربان تر، از طریق شریان ها کوچک تر و شریان چه ها کمک می کند.
شریان عضلانی کوچک که به قطر 100 میکرون و یا کمتر هستند ، به منظور تشکیل شریانچه های کوچک تر به قطر 20-30 میکرون ، تقسیم می شوند. در برخی بافتها ، خون می تواند به طور مستقیم از شریانچه ها و از طریق آناستوموز شریان وریدی به وریدچه ها وارد می گردد. با این وجود در اغلب موارد ، خون از شریانچه ها به داخل مویرگ ها عبور می کند. مویرگ ها باریک ترین عروق خونی هستند که به عنوان پایانه پر کار دستگاه گردش خون که مبادله گاز ها و مواد غذایی بین خون و بافت ها در آن به وقوع می پیوندد، عمل می کنند.
مویرگ ها:
دستگاه شریانی به طور گسترده در جهت انتقال خون به بیش از چهل بیلیون مویرگ بدن منشعب می گردد. گستردگی این انشعاب ها با این حقیقت مشخص می گردد که تمام سلول های بافت ها باید در فاصله 60-80 میکرونی از مویرگ ها قرار گیرند و این که مویرگ ها با مساحت بسیار زیادی جهت مبادله بین خون و مایع بافتی را فراهم سازند.
اغلب دستگاه وریدی حاوی خون هستند. بخشی از مقدار خونی که از طریق یک بستر مویرگی ویژه جریان می یابد به وسیله عضلات اسفنکترهای پیش مویرگی تعیین میشود.
بر خلاف دستگاه عروقی شریان و ورید د، دیواره های مویرگی فقط از یک لایه سلول ( بافت پوششی ساده سنگفرشی یا آندوتلیوم) تشکیل شده است تا انتقال سریع مواد بین خون و بافت ها را فراهم سازد.
انواع مویرگ ها:
اعضا مختلف بدن دارای انواع مختلفی از مویرگ ها هستند که به واسطه دارا بودن اختلاف ساختمانی آشکاری تشخیص داده می شوند. با در نظر گرفتن پوشش آندوتلیال پیوسته، مویرگ های واجد آندوتلیال نا پیوسته و مویرگ های منفذ دار می باشند.
مویرگ های پیوسته آن دسته مویرگ هایی هستند که سلول های آندوتلیالی مجاورشان به طور کاملا نزدیکی به یکدیگر متصل هستند. این نوع مویرگ های دارای آندوتلیال پوسته در CNS (دستگاه عصبی مرکزی) واجد کانال های بین سلولی اند و درتشکیل سد خونی – مغزی شرکت می کنند. مویرگ های دارای آندوتلیال پیوسته در اعضای دیگر کانال های پیوسته در اعضا دیگر کانال های بین سلولی باریک دارند که عبور سایر مولکول ها ، به جز پروتئین ها را بین خون مویرگی و مایع بافتی ممکن می سازند.به نظر می رسد این نوع انتقال یگانه مکانسیم قابل دسترس برای مبادله مویرگی در دستگاه عصبی مرکزی بوده، یا احتمالا بخشی از طبیعت انتخابی سد خونی محسوب می شود.
کلیه ها، غدد درون ریز، و روده ها حاوی مویرگ های منفذدار هستند که به وسیله منافذ بین سلولی عریض شان مشخص می شوند و به واسطه لایه موکوپروتئینی که ممکن است به صورت دیاگرام عمل نماید، مفروش شده اند.
د رمغز استخوان ، کبد و طحال فاصله بین سلول های آندوتلیال خیلی زیاد بوده، تا جایی که این مویرگ های دارای آندوتلیال تا پیوسته در عضو به صورت حفره های کوچکی ( سینوزوئید ها) به نظر می رسند.
وریدها :
بر خلاف شریان ها که در مقابل جریان خون قلب مقاومت ایجاد می کنند، ورید ها می توانند با انباشت مقادیر اضافی خون متسع گردند.
فشار وریدی پایین برای بازگشت خون به قلب ، به ویژه از اعضای پایین تر قلب ، کافی نیست. با وجود این ، وریدهای قرار گرفته بین دستجات عضله اسکلتی فشرده می شوند، جریان یکسویه خون به قلب به واسطه وجود دریچه های وریدی فراهم می گردد.
اغلب اثر عمل ماساژ دهندگی عضلات اسکلتی بر جریان خون وریدی به عنوان پمپ عضله اسکلتی توصیف می گردد. هنگامی که این پمپ کم تر فعال می شود، مثل زمانیکه فرد خوابیده و یا ایستاده، خون در ورید ها انباشته شده، موجب اتساع آنها می شود. زمانی که فعالیت فرد بیشتر می شود، خون با سرعت بیشتری به خون بازگشته ، خون کمتری در دستگاه وریدی باقی می ماند.
عمل پمپ های عضله اسکلتی به برگشت خون وریدی اندام تحتانی به سوی ورید های بزرگ تر شکمی کمک می کند. با وجود ا ین ، حرکت خون وریدی از ناحیه شکمی به سوی وریدهای سینه ای ، به وسیله مکانسیم کمکی دیگری ( مکانیسم تنفس) بیشتر تسهیل میشود.
تصلب شرایین و آریتمی های قلبی:
تصلب شرایین روند بیماریی است که می تواند به انسداد جریان خون کرونری منجر گردد.در نتیجه، ممکن است به واسطه چنین بیماری، خواص الکتریکی قلب و توانایی آن به عنوان یک پمپ به طور جدی به خطر بیافتد. می توان این ریتم های غیر عادی قلبی ، یا آریتمی ها را به وسیله مشاهده الکتروکاردیوگرام های غیر عادی کشف کرد.
تصلب شرایین :
روند تصلب شرایین در اثر آسیب به آندوتلیوم شروع می شود.چنین آسیب هایی به وسیله استعمال دخانیات ، هیپرتانسیون (فشار خون بالا) ، کلسترول بالای خون و دیابت بوجود می آیند.
گاه این روند ممکن است به وسیله آسیب وارده به آندوتلیوم ایجاد شود،ولی به نظر میرسد توسعه آن از انواع گسترده سیتوکین ها و سایر تنظیم کننده های اتوکرینی ترشح شده به وسیله آندوتلیوم و سایر مولکول های شرکت کننده ( پلاک ها ، ماکروفاژ ها و لنفوسیتها) ناشی شود.[یاد آوری: تنظیم کننده های اتوکرینی در حفظ یکپارچگی عروق خونی مهم اند.]
برخی از این تنظیم کننده ها ماکروفاژها و لنفوسیت ها را به طرف آندتلیوم آسیب دیده جلب کرده، موجب نفوذ آنها به داخل لایه می شوند.
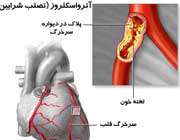
سلول های عضله صاف از وضع انقباضی موجود به وضع صناعی تغییر یافته تری تبدیل شده، بدان وسیله ، پروتئین ماده زمینه بافت پیوندی را ایجاد و ترشح می کنند.( این امر در سایر بافت هابه علت ترشح ماده زمینه ای بافت پیوندی و به وسیله سلول هایی به نام فیبروبلاست ها منحصر به فرد است.) سلول های تغییر یافته عضله صاف در پاسخ به مواد شیمیایی جلب کننده از لایه میانی به طرف لایه درونی ، جایی که میتوانند تکثیر بیابند، مهاجرت می کنند.
در برابر این پیشرفت و در مقابل نفوذ منوسیت ها و لنفوسیت ها سلول های آندوتلیال به طور طبیعی ، به وسیله ترشح تنظیم کننده ای اتوکرین، مانع ایجاد می کنند.
کلسترول و لیپوپروتئین های پلاسما
شواهد خوبی وجود دارد که ارتباط بین کلسترول بالای خون را با افزایش خطر تصلب شرایین اثبات می کند.
لیپیدها ، از جمله کلسترول،در خون به صورت متصل به پروتئین های حامل انتقال می یابد. کلسترول به وسیله پروتئین های پلاسما، به نام لیپوپروتئین با چگالی کمتر (LDL) به شریان ها انتقال می یابد. بخش داخلی کلسترولی این ذرات تولید شده به وسیله کبد با لایه ای از فسفولیپیدها( جهت حمل ذره آب) و پروتئین ها ترکیب شده اند. سلول های اعضای مختلف برای پروتئین های موجود در LDL حاوی گیرنده اند.زمانی که پروتئین های LDL به گیرنده های خود وصل نیشوند از طریق آندوسیتوز با واسطه گیرنده سلول LDL را بلعیده، کلسترول را برای مقاصد مختلف مورد استفاده قرار می دهند. اغلب ذرات LDL موجود در خون به این طریق به وسیله کبد برداشت می شوند. به محض عبور پروتئین ها از آندوتلیوم شریانی ، ممکن است مونوسیت ها جهت ورود به آن ناحیه و بلعیدن کلسترول تحریک شوند. آنگاه مونوسیت ها ممکن است به وسیله LDL تحریک شده ، با ترشح عامل رشدی در توسعه و ایجاد یک آتروم( پلاکت های موضعی) و شروع آن شرکت داشته باشند. وجود غلظت بالای LDL این روند را آسان می کند.شواهد اخیر نشان می دهد اشخاصی که رژیم غذایی با کلسترول بالا و چربی اشباع شده مصرف می کنند ونیز افراد دارای هیپرکلسترمی ( وضیعت توارثی) خانوادگی غلظت بالایی از LDL دارمد به علت کمی تعداد گیرندهای LDL در بافت هدف (به طور عمده کبد) است.با تعداد کم گیرنده هایLDL ، کبد توانایی کم تری جهت برداشت LDL خون داشته، با افزایش غلظت LDL خطر تصلب شرایین به مقدار زیادتری افزایش می یابد.
ممکن است کلسترول مازاد از سلول ها آزاد گردیده ، ضمن حرکت در خون به صورت لیپوپروتئین های با چگالی بالا ( HDL) و به وسیله کبد برداشته شوند.کلسترول درون HDL قادر نیست از طریق جدار شریان وارد شود، زیرا این سلول ها فاقد گیرنده های غشایی مورد نیاز برای آندوسیتوز ذرات HDL هستند. از این رو کلسترول موجود درHLD در مقام مقایسه با LDL سودمندترمی باشد، زیرا می تواند حرکت نسبت بالایی از کلسترول از عروق خونی به سوی کبد را نشان دهد.به طور کلی غلظت کلسترولHDL در زنان بیشتر از مردان است و خطر تصلب شرایین در آنها از مردان کم تر است.
بیماری ایسکمیک قلب
زمانی بافتی ایسکمیک است که اکسیژن ناکافی در اثر جریان خون ناکافی دریافت کند.علت بسیار متداول ایسکمی عضله قلبی، تصلب شرایین کرونر است. در چنین شرایطی کفایت جریان خون نسبی بوده ، به نیاز های اکسیژنی بافت بستگی دارد.برای مثال وجود انسدادی در شریان کرونر ممکن است امکان جریان خون کافی را در حالت استراحت فراهم ساخته ، اما زمانی که قلب در اثر ورزش و یا شرایط تحت فشار باشد، ایسکمی ایجاد کند.
ایسکمی عضله قلب با افزایش غلظت خونی اسید لاکتیک که به وسیله تنفس غیر هوازی در بافت ایسکمیک تولید می گردد، ارتباط دارد.
سلول های عضلانی قلب جهت انجام تنفس هوازی سازش یافته ، نمی توانند برای بیش از چند دقیقه به طور غیر هوازی تنفس کنند.اگر ایسکمی و تنفس غیر هوازی به مدت بیش از چند دقیقه ادامه یابد، ممکن است نکروز( مرگ سلولی ) در نقاطی که بیشترین محرومیت اکسیژنی را دارد، به وقوع بپیوندد.یک آسیب غیر قابل برگشت ناگهانی از این نوع ، انفارکتوس میوکاردی خوانده می شود. گرچه کاربرد اصطلاح غیر حرفه ای « حمله قلبی» دقیق نیست، معمولا این اصطلاح در مورد انفارکتوس قلبی به کار میرود.ایسکمی عضله قلب را می توان به واسطه تغییرات حاصل در قطعه ST الکتروکاردیوگرام (پایین افتادگی قطعه ST در نوار الکتروکاردیوگرام ) تشخیص داد. همچنین اندازه گیری آنزیم هایی که به وسیله بافت ایسکمیک در خون رها میشود، به تشخیص انفارکتوس عضله قلب کمک میکند.
شناخت آریتمی ها به وسیله EGC
آریتمی ها یا ریتم های غیر عادی قلب را می توان به وسیله ردیابی EGC غیر عادی ایجاد شده از آنها مورد شناسایی و توصیف قرار داد.
از آنجایی که یک ضربان قلب در زمان وقوع یک مجموعه عادی QRS مشاهده می گردد، و نیز کاغذ مدرج EGC با سرعت معمولی حرکت می کند، می توان تعداد ضربان قلب ( در دقیقه ) را با توجه به محورX که نمودار زمان است، از بررسی EGC بدست آورد.تعداد ضربان کم تر از شصت ضربان در دقیقه نمودار کاهش ضربان یا برادیکاری بوده ، و تعداد ضربان سریع تر از صد ضربان در دقیقه تاکیکاردی یا افزایش ضربان قلب را توصیف می کند.
به طور طبیعی هم تاکیکاردی و هم برادیکاردی ممکن است به وقوع پیوندد. به عنوان مثال ، قهرمانان ورزشی که به طور مستمر تمرین دارند، اغلب تعداد ضربان 40 یا 50 بار در دقیقه دارند. این برادیکاردی به نوبه خود نوعی سازش سود بخش می باشد. و یا فعالیت دستگاه سمپاتیک ، طی ورزش و یا حالت های اضطراری موجب وقوع تاکیکاردی طبیعی می شود.
تاکیکاردی غیر عادی زمانی به وقوع می پیوندد که شخص در حالت استراحت بسر می برد. این امر ممکن است ناشی از آهنگ سریع و غیر معمول پیشرفت تحریک در دهلیز ها به واسطه داروها بوده ، و یا از گسترش غیر عادی نقاط ضربان ساز( پیس میکر های) نابجا باشد( سلول هایی مه خارج از گره SA قرار گرفته و عمل ضربان سازی را به عهده می گیرند). از این رو تاکیکاردی غیر معمول دهلیز ها از تاکیکاردی طبیعی سینوسی ( گره SA) متفاوت می باشد.تاکیکاردی بطن ها زمانی ایجاد می گردد که نقاط ضربان ساز تند نابجا در بطن ها موجب زنش سریع و کاملا مستقل آن ها از دهلیز ها شود. این امر بسیار خطرناک بوده ، به سرعت می تواند به وضع کشنده ای تغییر یابد که فیبریلاسیون بطنی نامیده میشود.
فلوتر و فیبریلاسیون
ممکن است تحریک الکتریکی و انقباض در دهلیز ها و بطن ها با سرعت بسیار سریع به وقوع پیوندد. در فلوتر، انقباضات بسیار سریع ( 200-300 بار در دقیقه) ولی موزون است.
در فبیریلاسیون ، وقوع انقباضات دستجات مختلف الیاف عضلانی قلب در زمان های گوناگون عمل پمپی موزون حفره ها را غیر ممکن می سازد.
معمولا فلوتر دهلیزی به طور سریع به فیبریلاسیون دهلیزی تغییر حالت می یابد. این امر موجب توقف عمل پمپی دهلیز ها می گردد. از آنجایی که بطن ها در حجم پایان دیاستولی خود تا حدود 80% قبل از وقوع انقباض طبیعی دهلیز ها پر می شوند، قلب می تواند مقدار کافی خون را به داخل گردش خون تخلیه کند. از این رو افرادی که فبیریلاسیون دهلیزی دارند می توانند سال ها متمادی زندگی کنند. در مقابل افراد مبتلا به فیبریلاسیون بطنی فقط به مدت چند دقیقه از پس توقف عمل مغز و قلب ( که جهت متابولیسم خودشان وابستگی زیادی به اکسیژن دارند) زنده می مانند.
فیبریلاسیون در اثر چرخش مستمر و دوباره امواج الکتریکی ، به نام ریتم های سرگردان در میوکارد بوجود می آید. در حقیقت به طور طبیعی از این چرخش دوباره، به علت ورود همزمان تمام میوکارد به دوره تحریک ناپذیری جلوگیری می شود. چنانچه در برخی از سلول ها، دوره تحریک ناپذیری قبل از سایر سلول ها بروز نماید، امواج الکتریکی می تواند به طور مستمر تولید هدایت شود.چرخش مجدد امواج الکتریکی در امتداد مسیر های دائما تغییر یابنده ، انقباضات ناموزون و عمل پمپی ناتوان کننده ای را بوجود می آورند.
برخی مواقع فبیریلاسیون می تواند به وسیله شوک الکتریکی قوی اعمال شده به قفسه سینه متوقف شود. این روش دفیبریلاسیون الکتریکی خوانده می شود.شوک الکتریکی همه سلول های میوکارد را به طور همزمان دپلاریزه کرده ،در عوض دو دقیقه گره SA میتواند شروع به تحریک انقباض به روش عادی بکند. این امر علت اصلی اختلال را که موجب ریتم های چرخشی و فیبریلاسیون گردیده بود، اصلاح نمی کند، ولی میتواند شخص را تا اتخاذ سایر روشها ی اصلاح کننده زنده نگه دارد.
انسداد گره AV
فاصله زمانی بین شروع دپولاریزاسیون دهلیزی با موج P و شروع دپولاریزاسیون بطنی به وسیله بخش Q کمپلکس QRS را نشان می دهد. این فاصله زمانی گاه فاصله زمانی PR نامیده می شود. در قلب لین فاصله زمانی 0.12 تا 0.20 ثانیه است.
آسیب به گره AV موجب کندی هدایت ایمپالس شده ، به وسیله تغیرات در فاصله PR منعکس شود.
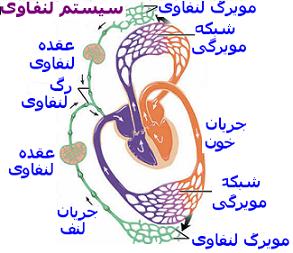
دستگاه لنفاوی:
عروق لنفاوی مایع بافتی اضافی را جذب کرده، آن را از طریق مجاری تخلیه ای که در این حال لنف خوانده می شود، به داخل ورید ها انتقال می دهند. گره های لنفاوی که بافت های لنفاوی تیموس ، طحال و لوزه ها، لنفوسیت ها را تولید می کنند، در این فرایند ایمنی مشارکت می کنند.
دستگاه لنفاوی سه عمل اساسی دارد:
1. مایع بافتی بینابینی را که درابتدا تحت عنوان فیلترای خون تشکیل شده و به خون برگشته، انتقال می دهد.
2. چربی جذب شده از روده را به خون انتقال میدهد.
3. سلول های لنفی( لنفوسیت ها) دفاع ایمونولوژیک بر ضد عوامل به وجود آورنده بیماری فراهم میکنند.
کوچک ترین عروق دستگاه لنفاوی مویرگ های لنفاوی هستند. مویرگ های لنفاوی مجاری ریزی با انتهای بسته اند که شبکه های وسیعی را در فضاهای بین سلولی اغلب اعضا تشکیل می دهند. از آنجایی که دیواره مویرگ ها ی لنفاوی از سلول های آندوتلیالی با اتصالات منفذ درا تشکیل شده ، مایع میان بافتی ، پروتئین ها، میکروارگانیسم ها ، و چربی جذب شده(در روده) ممکن است به سهولت به داخل آنها وارد شوند. به م حض ورود مایع به مویرگ های لنفاوی، عنوان لنف به مایع موجود در آنها اطلاق می شود. از اتحاد لنف موجود در مویرگ های لنفاوی ، لنف بهعروق لنفاوی بزرگ تر حمل می شود.
عروق لنفاوی در نهایت به داخل یکی از دو عروق اصلی ، مجرای سینه ای و مجرای لنفاوی راست ،تخلیه می شوند. این مجاری به ترتیب لنف را به داخل وریدهای تحت ترقوه ا ی چپ و راست تخلیه میکند.بدین ترتیب ، مایع بین بافتی ، که از طریق تصفیه پلاسما در بیرون از مویرگ های خون تشکیل شده بود، در نهایت به دستگاه قلبی عروقی برگردانده میشود.
قبل از اینکه لنف به دستگاه قلبی-عروقی برگردانده شود، از طریق گره های لنفاوی فیلتره می شود.گره های لنفاوی هم حاوی سلول های فاگوسیتی اند که جهت برداشتن عوامل بیماری زا کمک می کنند و هم دارای مراکز زایشی اند، چرا که جایگاه تولید لنفوسیت هستند. لوزه ها، تیموس، و طحال ( که در مجموع بافت های لنفوئیدی نامیده میشوند) همچنین حاوی مراکز و یا جایگاه های تولید لنفوسیت می باشند.
منبع:فیزیولوژی انسان
مطالب مرتبط:
طبقه بندی مطالب وبلاگ فیزیوتراپی
مقالات قلب و عروق (شامل مفاهیم، اختلالات و مقاله های آموزشی)
مقالات حرکت شناسی (کینزیولوژی)
مقالات سیستم عضلانی-اسکلتی، بیماری ها و اختلالات مربوطه
مقالات شکستگی استخوانها و جراحی های ارتوپدی
مقالات روماتولوژی (شامل اصطلاحات،اختلالات و بیماریهای روماتیسمی و روماتیسم خارج مفصلی)
مقاله های دستگاه عصبی مرکزی و محیطی (CNS & PNS)
مقالات سیستم عصبی، بیماریها و اختلالات مربوطه
مقالات سیستم تنفسی، بیماریها و اختلالات مربوطه
مقاله های سیستم حسی، درد و موضوعات آن
مقالات سیستم عروقی، بیماریها و اختلالات مربوطه
مروری بر آناتومی سیستم عصبی، عضلانی و اسکلتی ازطریق تصاویر
 Iran
Iran